首个国产靶向药美国获批,贝达药业迎来高光时刻
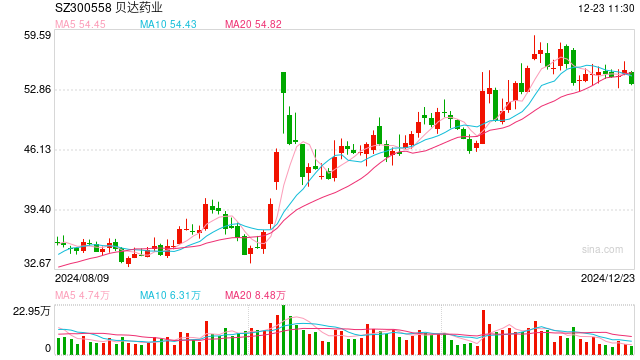
日前,生物科技公司贝达药业(300558.SZ)宣布,由控股子公司 Xcovery 开发的盐酸恩沙替尼胶囊(商品名:Ensacove)正式获美国FDA批准,适应症为既往未接受过ALK抑制剂治疗的ALK阳性局部晚期或转移性非小细胞肺癌(NSCLC)成年患者的一线治疗。
这一获批标志着恩沙替尼成功进入美国市场,为公司进一步拓展海外销售渠道提供条件,亦为该产品重要里程节点。在此之前,恩沙替尼已在中国获得二线(2020年11月由NMPA批准)及一线(2022年3月由NMPA批准)治疗适应症,并于2023年12月纳入国家医保。这些时间节点与监管进展共同构成了恩沙替尼临床价值和商业前景提升的关键里程碑。
恩沙替尼是一款由贝达药业与Xcovery开发的新一代高选择性ALK抑制剂,与全球已有五款ALK阳性一线治疗药物(克唑替尼、阿来替尼、布格替尼、塞瑞替尼、洛拉替尼)同台竞争。该药品此前已在中国顺利推进III期术后辅助治疗适应症的临床研究,并在2024年之前多次公告了包括临床审批、上市批准以及医保目录纳入等关键进展。
对于公司而言,其象征意义或大于实际贡献。资料显示,ALK阳性非小细胞肺癌(NSCLC)的患者群体比例相对较小,仅占非小细胞肺癌患者3%-5%,远低于EGFR等突变频率更高的基因类型。非小细胞肺癌中EGFR突变的比例可高达30%-40%,KRAS约25%,因此EGFR抑制剂在市场规模上更具优势。与EGFR-TKI相比,ALK抑制剂的市场空间相对有限。
在国内,恩沙替尼的获批时间点使其无论在二线还是一线适应症上均未能取得显著的先发优势。克唑替尼、塞瑞替尼和阿来替尼等ALK抑制剂在2013年和2018年已相继登陆国内市场并积累了相对成熟的销售渠道与医生认可度。数据显示,克唑替尼在中国院内销售峰值接近10亿元,2022年销售额为8.12亿元,成为与恩沙替尼争夺市场的强劲对手。
恩沙替尼作为贝达药业继埃克替尼(凯美纳)之后的另一款国产1类新药,能够获美国FDA批准一线适应症上市,成为首个由中国企业主导在美国上市的小分子肺癌靶向创新药,依然是令人“刮目相看”的事件。贝达药业自2003年成立,于2016年11月深交所上市,其主要产品包括自主研发的埃克替尼(凯美纳)和恩沙替尼(贝美纳)。
今年以来贝达药业财务表现亮眼。今年前三季度公司录得营收23.45亿元,同比增长14.73%,归母净利润4.162亿元、扣非净利润3.616亿元,同比增幅分别为36.61%和50.12%。其中,埃克替尼(凯美纳)作为首个国产EGFR-TKI,是公司历年来的业绩支柱,自2011年获批以来其累计销售额已超100亿元;恩沙替尼在获批一线适应症后对公司业绩提振仍有限。
另一方面,公司2023年员工总数减少25人,研发人员减少85人。9月中旬,董事、资深副总裁兼首席科学家离职的消息更引发市场关注。公司今年前三季度研发费用从4.68亿元下降至3.84亿元,表明公司似乎更加注重短期的业绩表现,而削减研发支出是最有效的方式。